A circulação do SARS-CoV-2 na população global tem levado ao surgimento de novas variantes que ameaçam prejudicar a eficácia de vacinas. Entendendo a resposta imunológica e suas habilidades neutralizantes tanto ao nível do paciente quanto globalmente poderá não apenas auxiliar na prevenção de surtos, mas também mitigar o surgimento de futuras pandemias.
A propagação do vírus SARS-CoV-2 por mais de 2 anos após o surgimento da COVID-19 representa uma gigantesca crise de saúde global para a comunidade e hospitais enquanto desestabiliza o crescimento econômico. Novas variantes de preocupação (VOCs) têm surgido desde o início da pandemia pela circulação prolongada do vírus na população mundial e pelos casos crescentes. Estas variantes possuem características evolucionárias que podem aumentar sua transmissão e virulência enquanto diminui a efetividade de vacinas, testes diagnósticos e terapias.
Até o momento, A Organização Mundial da Saúde (OMS) identificou 5 VOCs: Alfa (Alpha), Beta, Gama (Gamma), Delta e Omicron e adicionalmente oito Variantes de Interesse (VOIs): Epsilon, Zeta, Eta, Teta (Theta), Iota, Capa (Kappa), Lambda e Mu. O surgimento das VOCs e VOIs impôs uma ameaça tanto para profisionais da saúde quanto criadores de políticas públicas na manutenção da pandemia. Assim, levantar o estado imunológico da população e monitorar evolução de variantes são a chave para assegurar uma resposta rápida para novos surtos e avaliar o espalhamento da COVID-19.
Monitorando Resposta de Anticorpos em Indivíduos Assintomáticos
Como por volta de 80% das infecções de SARS-CoV-2 são medianas ou assintomáticas, não é de surpreender que a transmissão por assintomáticos e pré-sintomáticos é o fator de maior peso para a disseminação de COVID-19 (Eckerle and Meyer 2020). Desta forma, monitorar apenas indivíduos sintomáticos não leva em conta o estado imunológico de grande parte da população atualmente ou já infectada com SARS-CoV-2. Combinar de forma inteligente diversas ferramentas de vigilância em estudos de soroprevalência pode auxiliar pesquisadores a entender como a COVID-19 é disseminada na população geral, enquanto avaliam a resposta por anticorpos e imunidade protetiva tanto por infecções naturais quanto vacinação em indivíduos sintomáticos ou não. Esta informação não é apenas útil para o controle da COVID-19, mas também pode auxiliar estratégias de resposta a pandemias futuras.
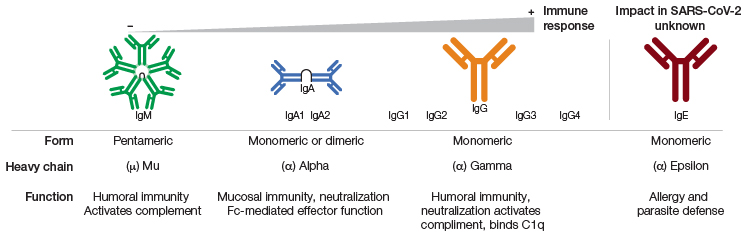
Ensaios multiplex, como os Bio-Plex Pro Human SARS-CoV-2 IgA, IgM, and IgG Assays, proporcionam dados da resposta humoral específica por isotipo contra proteínas do Nucleocapsídeo (N), Spike 1 (S1), Spike 2 (S2) e RBD de SARS-CoV-2 simultaneamente em menos de 3 horas. Isto permite a pesquisadores mensurarem a resposta isotipo-específica associada a diferentes estágios de infecção e a distinguirem a resposta de anticorpos IgA, IgM e IgG entre infecção natural e mediada por vacina (Fenwick et al. 2021a).
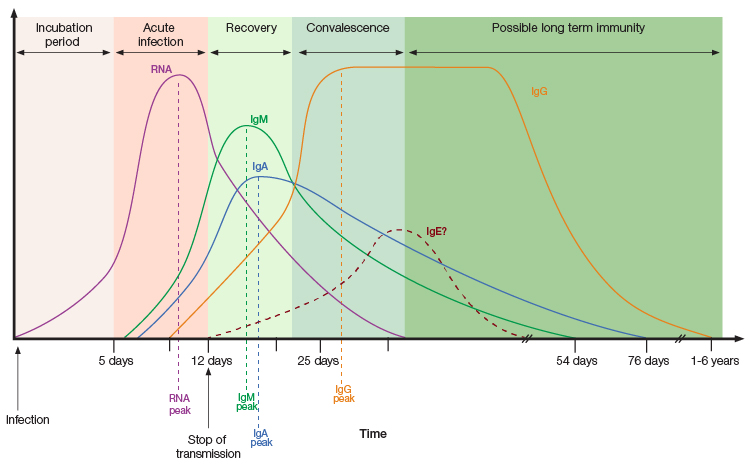
A IgA é produzida pouco após exposição ao patógeno, protegendo as barreiras epiteliais e modulando respostas imunológicas durante a inflamação. Foi observado que a reposta oportuna de IgA ao SARS-CoV-2 contribui significantemente para a neutralização viral, enquanto sua ausência logo após infecção pode estar associado com a progressão da COVID-19 severa, falha na vacinação, e persistente carga viral em pacientes com imunodeficiências (Quinti et al. 2021). Níveis de IgM são tipicamente dominantes nos estágios iniciais de infecção, enquanto níveis de IgG atingem pico semanas após exposição inicial (Liu et al. 2020). Entretanto, uma resposta de IgM retardada foi observada em pacientes com progressão severa da COVID-19 (Shen et al. 2020). Pacientes com COVID-19 severa apresentaram altos níveis de IgG nos estágios finais da doença quando comparado com pacientes portadores de sintomas medianos (Liu et al. 2020).
Assim, testes sorológicos podem auxiliar a descrever todo o espectro de respostas mediadas por anticorpo isotipo-específico associadas com diferentes estágios da doença e severidades dos sintomas para ajudar na redução da progressão dos sintomas e melhorar o desfecho de pacientes. Pesquisadores também podem utilizar este conhecimento para monitorar a eficácia vacinal ao decorrer do tempo e determinar a necessidade de adjuvantes em indivíduos vulneráveis (Scurr et al. 2022).
Rastreando Variantes Emergentes
A circulação do SAES-CoV-2 pela população mundial facilitou o surgimento de VOCs com mutações ligadas a consequências epidemiológicas significativas, como transmissão elevada, virulência, e evasão de respostas imunológicas. A última VOC, Omicron, pode evadir imunidade de infecções passadas e/ou duas doses vacinais (Ferguson et al. 2021). Isto evidencia a urgência no monitoramento rotineiro da disseminação de variantes dentro da população. O avanço de infecções e o surgimento de novas variantes, pode desafiar e/ou prejudicar os programas vacinais atuais.
Ainda ao rastrear variantes, pesquisadores precisam entender o tipo e longevidade da resposta imunológica humoral. Caracterizar a resposta de anticorpos pode auxiliar a diferenciar entre indivíduos vacinados que possuem apenas anticorpos anti-spike e indivíduos que foram expostos ao vírus naturalmente e podem ter títulos mais altos de anticorpos contra as subuinidades S1 (incluindo RBD) e S2 tanto quanto a proteína N. Anticorpos neutralizantes são capazes de prevenir a entrada viral nas células humanas bloqueando a ligação de S1 RBD do SARS-CoV-2 so receptora da enzima conversora de angiotensina 2 (ACE2). No entanto, este não é o caso para todos os anticorpos, especialmente aqueles que se ligam a variantes como Omicron com múltiplas mutações na subunidade RBD, permitindo a fuga parcial da neutralização por anticorpos (Fenwick et al. 2021b; preprint: Seki et al. 2022; Cele et al. 2022).
Ensaios de neutralização por anticorpos, como os ensaios Bio-Plex Pro Human SARS-CoV-2 Neutralization Antibody Assay, permitem que pesquisadores monitorem a eficácia de vacinas de COVID-19 e a comparem com a resposta de anticorpos de ocorrência natural frente a VOCa e VOIs emergentes. Estes ensaios específicos mensuram quantitativamente anticorpos neutralizantes de SARS-CoV-2 contra duas proteínas selvagens (wildtype), 11 variantes da RBD e S1. Neste cenário que variantes de SRAS-CoV-2 mudam rapidamente, o kit de desenvolvimento de ensaios customizados Bio-Plex Pro Human SARS-CoV-2 Neutralization Antibody pode ser utilizado para desenvolver ensaios de anticorpos neutralizantes com quaisquer novas VOC ou VOI. Os resultados podem auxiliar decisores de políticas públicas e de saúde a terem decisões baseadas em cada vez mais informações em variantes emergentes.
Mantendo o ritmo com variantes Emergentes
Neste estágio pós-vacina da pandemia, a resposta científica passou a ser monitorar novas variantes de SARS-CoV-2 e identificar fatores de risco associados com maior transmissão, virulência, e evasão do sistema imunológico. Para manterem-se à frente de novas variantes, decisores de políticas públicas e agentes de saúde precisam focar na testagem comunitária para assegurarem-se de que vacinas se mantém efetivas e para detectar surtos a tempo. Uma plataforma de monitoramento completa auxiliará a avaliação da disseminação de SARS-CoV-2 dentro de uma comunidade, permitindo governos a estarem de prontidão e responderem de forma eficiente a quaisquer pandemias quer surjam no futuro.
Fonte: Bioradiations
Referências
Cele S et al. (2022). Omicron extensively but incompletely escapes Pfizer BNT162b2 neutralization. Nature 602, 654–656.
Eckerle I and Meyer B (2020). SARS-CoV-2 seroprevalence in COVID-19 hotspots. The Lancet 396, 514–515.
Fenwick C et al. (2021a). Changes in SARS-CoV-2 spike versus nucleoprotein antibody responses impact the estimates of infections in population-based seroprevalence studies. J Virol 75, e01828–20.
Fenwick C et al. (2021b). A multiplexed high-throughput neutralization assay reveals a lack of activity against multiple variants after SARS-CoV-2 infection. medRxiv. Preprint. https://doi.org/10.1101/2021.04.08.21255150, accessed March 24, 2022.
Ferguson N et al. (2021). Growth, population distribution and immune escape of Omicron in England. Imperial College London. https://doi.org/10.25561/93038, accessed March 24, 2022.
Galipeau Y et al. (2020). Humoral responses and serological assays in SARS-CoV-2 infections. Front Immunol 11, 610,688.
Quinti I et al. (2021). IgA antibodies and IgA deficiency in SARS-CoV-2 infection. Front Cell Infect Microbiol 1, 655,896.
Liu X et al. (2020). Patterns of IgG and IgM antibody response in COVID-19 patients. Emerg Microbes Infect 9, 1,269–1,274.
Scurr MJ et al. (2022). Whole blood-based measurement of SARS-CoV-2-specific T cells reveals asymptomatic infection and vaccine immunogenicity in healthy subjects and patients with solid-organ cancers. Immunology 165, 250–259.
Seki Y et al. (2022). Safety and immunogenicity of Pfizer/BioNTech SARS-CoV-2 mRNA third booster vaccine against SARS-CoV-2 Omicron variant in Japanese healthcare workers. medRxiv. Preprint. https://doi.org/10.1101/2022.01.20.22269587, accessed March 24, 2021.
Shen L et al. (2020). Delayed specific IgM antibody responses observed among COVID-19 patients with severe progression. Emerg Microbes Infect 9, 1,096–1,101.
Variants of Concern, World Health Organization. https://www.who.int/en/activities/tracking-SARS-CoV-2-variants/, accessed March 24, 2022.
Fonte: Bioradiations



