Por: Bárbara Du Rocher (Fiocruz-RJ / Explore Cytometry)
..
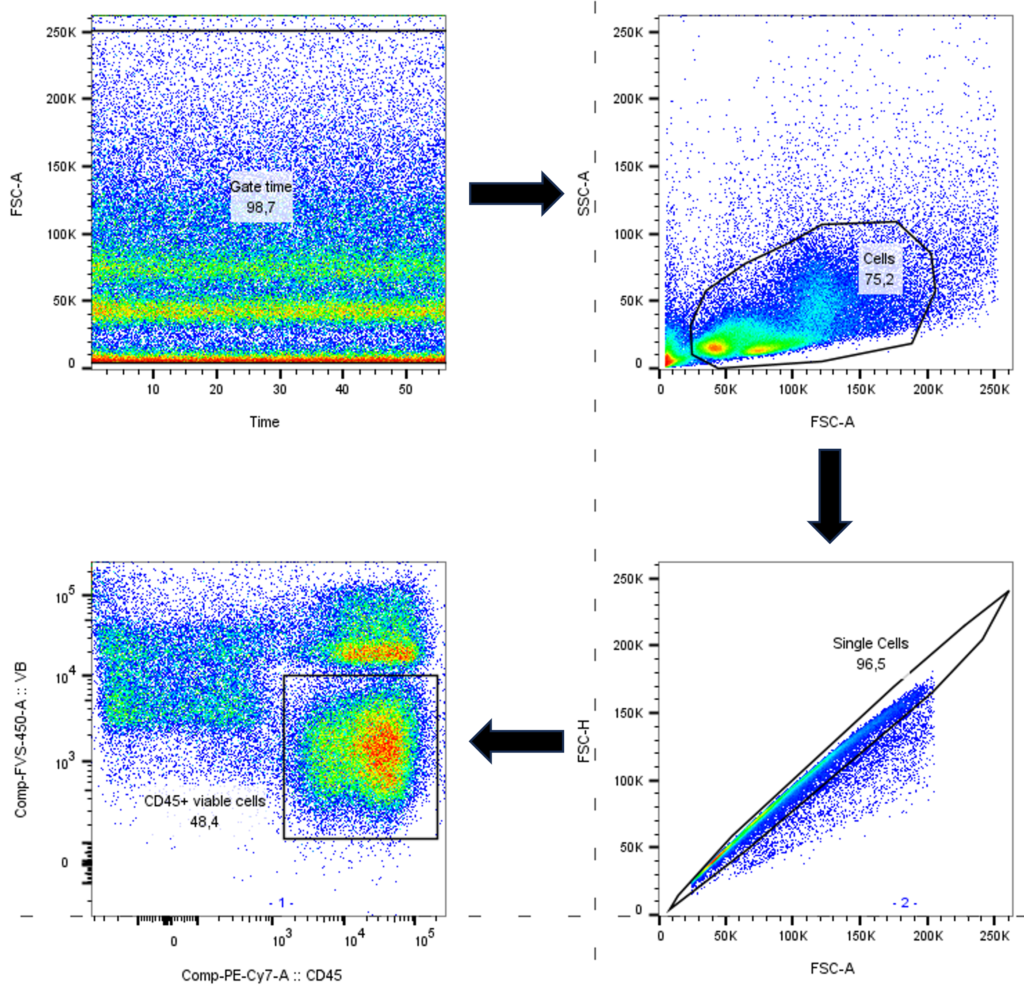
Analisar experimentos de citometria de fluxo pode ser bem desafiador, portanto, fazer uma boa estratégia de gate inicial, que permita a remoção de eventos não necessários ou de baixa qualidade, é fundamental para assegurar que somente dados de alta qualidade serão utilizados para a análise dos eventos de interesse.
Os gates iniciais devem seguir uma estratégia que vise remover debris, agregados celulares, células mortas ou ainda períodos de tempo em que microbolhas, microentupimentos ou ar foram introduzidos no sistema. Isso porque estas situações geram ruídos eletrônicos no equipamento, dados de baixa qualidade ou ainda marcação inespecífica e, portanto, comprometem a qualidade do seu dado.
.
,
Abaixo falarei pontualmente sobre cada um destes gates que compõem nossa estratégia inicial. compõem nossa estratégia inicial.
..
- Gate “tempo”: Inferência sobre a qualidade da aquisição!
..
É útil para detectar qualquer problema de ordem técnica que tenha ocorrido durante a aquisição, como presença de microbolhas de ar, micro entupimentos (ex: grumos celulares) ou tubo seco. Isso porque caso ocorra algum destes problemas o gráfico de tempo ficará com algumas “falhas” onde poucos eventos/segundos terão passado.
Ao detectar quaisquer destes problemas você pode remover este período, melhorando a qualidade do seu dado. Isso ocorre, pois, estes artefatos da técnica podem espalhar/desviar a luz emitida pelo fluorocromo, comprometendo uma leitura eficiente do dado pelo citômetro.
Além disso, no caso de uma obstrução, na medida em que o grumo de matérias e células começa a se soltar, um número grande de partículas pode surgir repentinamente diante do laser, podendo ser interpretadas erroneamente pelo citômetro como células maiores positivas para muitos marcadores, por exemplo.
Por fim, o ar introduzido no final de uma aquisição, por algum descuido, causa ruídos eletrônicos. Este “ar” pode gerar sinais de FSC e SSC que aparecem espalhados por todo o gráfico de FSC x SSC.
..
- Gate “FSC x SSC”: Inferência sobre tamanho e granulosidade!
..
Em amostras contendo dois ou mais tipos celulares facilmente identificáveis (como sangue periférico), a recomendação é fazer um gate em torno da população de interesse.
Noos casos onde isso não é possível, a recomendação é que ao menos os debris sejam removidos. Os debris ficam localizados no canto inferior esquerdo do gráfico de FSC x SSC.
Outra recomendação é não fazer um gate muito “justo” em torno da população de interesse, para não correr risco de perder parte das suas células.
Depois de concluir sua estratégia de gate, você pode fazer um “back gate” (Analisar novamente sua população final de interesse no gráfico de FSC x SSC para ver exatamente onde sua população de células está, podendo ajusta melhor se achar necessário).
..
- Gate “Single cells”: Remoção de doublets!
..
Se sua amostra estiver muito concentrada, pode acontecer de células e/ou partículas passarem muito próximas umas às outras diante do laser e o citômetro erroneamente interpretar isso como um único evento (o mesmo vale para agregados).
Por exemplo, uma célula CD4+CD8- passando junto com uma célula CD4-CD8+ podem ser interpretadas pelo citômetro como uma única célula duplo positiva CD4+CD8+ e isso claramente representa um problema.
Outro exemplo, um linfócito CD3+CD14- passando junto com um monócito CD14+CD3-podem ser interpretados pelo citômetro como uma célula CD3+CD14+. Neste último caso você pode erroneamente achar até que descobriu um novo tipo celular, mas o mais provável é que seu citômetro tenha interpretado como sendo uma única célula aquilo que na verdade eram duas células muito próximas.
Assim, é imprescindível remover estes eventos da nossa análise e para tal pode-se usar qualquer um deste gráficos: FSC-A x FSC-H, SSC-H x SSC-W ou FSC-H x FSC-W.
Aqui a recomendação é fazer um gate bem “apertado” removendo eventos muito largos (parâmetro Width – FSC-W) ou muito altos (parâmetro Height – FSC-H) em relação à média dos eventos e esta é a razão pela qual eu prefiro usar o gráfico FSC-A x FSC-H, já que a área (parâmetro Area – FSC-A) é a derivada dos dados de W e H (uma explicação mais detalhada sobre isso você encontra na nossa conta @explorecytometry).
..
- Gate “Live/dead” x algum marcador para enriquecimento!
..
Células mortas se ligam de forma inespecífica a anticorpos, assim, as mesmas devem ser removidas da sua análise utilizando-se um corante de viabilidade durante a marcação.
Além disso, nesta última estratégia, eu costumo combiná-lo num dotplot com algum marcador positivo que me forneça um enriquecimento celular. Um marcador muito útil, se você estiver trabalhando com leucócitos, é o CD45 pois todos os leucócitos o expressam. E ele será mais útil ainda se se você estiver estudando células provenientes de tecidos e órgãos que não são medula óssea, sangue periférico, baço e linfonodo, como por exemplo, intestino, fígado e pulmão. Isso porque as células hematopoiéticas nestes tecidos são raras e, portanto, utilizar um CD45 é uma maneira inteligente de enriquecer sua população de interesse, fazendo um gate nas células que são CD45.
Outra estratégia inclui utilizar marcadores negativos, o “Dump channel”. Aqui você irá utilizar um marcador ou um pool de marcadores que suas células não expressam (e fazer um gate na população negativa). Esta estratégia é inclusive muito utilizada na detecção de células tronco hematopoiéticas progenitoras (células LSK+), utilizando um pool de marcadores hematopoiéticos “maduros” definidores de linhagem e fazendo um gate na população Lin – (que contém o pool de marcadores negativos). Assim, ao plotar seu gráfico de viabilidade x marcador para enriquecimento (positivo ou negativo), você será capaz de fazer um gate com precisão nas suas células “vivas” de interesse.
..
Importante ressaltar que a ordem destes gates não importa muito, desde que você os faça. A ordem sugerida aqui é apenas a que faz sentido para mim, e a que costumo usar em quase todas as minhas análises.
Por fim, após esta limpeza dos dados, você estará pronto para começar a analisar seus eventos de interesse, agora com altíssima qualidade e não mais misturados a eventos que diminuiriam a precisão e acurácia da sua análise. No entanto, como esta última parte da estratégia de gates é extremamente particular para cada tipo de experimento, não existe uma recomendação padrão a ser seguida.
Portanto, agora vocês já sabem: Façam sempre esta estratégia inicial de gates e garanta resultados robustos. Boa análise e vejo vocês no @explorecytometry!!!
..
..

Por Bárbara Du Rocher
Pesquisadora-tecnologista em citometria de fluxo pela Fiocruz, RJ e fundadora do Explore Cytometry (@explorecytometry), plataforma de mídias sociais voltada para a divulgação da citometria de fluxo.
..
..
Referências bibliográficas
Site: https://marissafahlberg.com/beginner-gating-strategies-to-start-analyzing-your-flow-cytometry-data/
Mohamed A. E. Ali et al. DOI: 10.1038/s41598-017-11909-3. SCIENtIFIC REPOrTS. 2017. 7: 11442
Andrea Cossarizza et al. DOI: 10.1002/eji.202170126 Eur. J. Immunol. 2021. 51: 2708–3145. Guidelines for the use of flow cytometry and cell sorting in immunological studies (Third edition).
Andrea Cossarizza et al. DOI: 10.1002/eji.201646632 Eur. J. Immunol. 2017. 47: 1584–1797. Guidelines for the use of flow cytometry and cell sorting in immunological studies
Jamie A. Lee et al. DOI: 10.1002/cyto.a.20623. Cytometry A. 2008. 73: 926–930. MIFlowCyt: The Minimum Information about a Flow Cytometry Experiment
T Kalina et al. DOI: 10.1038/leu.2012.122. Leukemia. 2012. 26: 1986-2010. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols



