O rigoroso controle de qualidade durante a fabricação produz rendimentos mais seguros e terapias mais efetivas, ressaltam Mark White, Diretor Associado de Marketing de Produtos para biofarmacêuticos, e Marwan Alsarraj, Gerente do Segmento de Biofarmacêuticas na Bio-Rad Laboratories.
Em 1984, um paciente recebeu infusões de IL-2, estimulando suas próprias células T a expandir e atingir um tumor de melanoma metastático. O tratamento interrompeu completamente a doença, permitindo que a paciente permanecesse em remissão por 29 anos.
Ela foi apenas a primeira de muitos a se beneficiarem desse tipo de tratamento1. Com base neste e em outros sucessos da imunoterapia, as mais recentes terapias com células CAR-T aprimoram e fortalecem ainda mais a resposta imune natural, modificando geneticamente as células T de um paciente para transformá-las em câncer “killers” direcionadas2.
De acordo com ClinicalTrials.gov, esta abordagem excepcional inspirou mais de 350 ensaios CAR-T atualmente ativos3. Reconhecendo o potencial desses projetos, as agências reguladoras pretendem aprovar de 10 a 20 terapias celulares e genéticas por ano até 2025.4
À medida que o campo da imunoterapia amadurece, os desenvolvedores devem se adaptar. Esta área ainda é nova e a fabricação de uma “droga viva” não é totalmente padronizada. Os cientistas precisam de um controle de qualidade altamente sensível e acurado e ferramentas para monitorar células vivas dinâmicas, conforme elas são manipuladas durante o processo de fabricação, para assegurar que o produto será seguro e eficaz quando aplicado em cada paciente.
Guiando as células para procurar o câncer
Para produzir uma terapia baseada em células CAR-T, as células T são extraídas do sangue humano e modificadas – tipicamente utilizando a adeno-vírus associado ou lentivírus – para inserir um antígeno quimérico receptor (CAR) transgênico das células do genoma.
Depois as células crescem em um biorreator e se multiplicam até um volume adequado. Em seguida, um médico as transfunde de volta ao paciente, onde elas expressam a proteína CAR, que circula por todo o corpo e mata as células cancerígenas alvo.
Quando uma terapia está passando por testes clínicos, as células produzidas podem variar significativamente de lote para lote. Os desenvolvedores utilizam várias abordagens para produzir diferentes terapias de células CAR-T, e cada lote de cada terapia é feito com matéria-prima diferente: as células T de um paciente que provavelmente já recebeu outros tratamentos, podem ter seu crescimento e comportamento afetados.
Para levar em conta a maior possibilidade de variação, os desenvolvedores devem monitorar as células em produção usando medidas rigorosas de controle de qualidade para garantir produtos seguros e eficazes.
Métodos moleculares são usados para testar elementos chave como potencial da célula CAR-T, persistência e presença de contaminantes. Essas práticas de controle de qualidade maximizam os benefícios, minimizam o risco de danos ao paciente e promovem ótimos resultados de ensaios clínicos para melhorar as chances de a terapia chegar ao mercado.
Trabalhando a dosagem ideal
O processo de transfecção do transgene CAR em células T é coordenado, em parte, pelo acaso. Quando o gene CAR é introduzido em células T, zero, uma ou múltiplas cópias do gene podem integrar o genoma da célula.
As condições do laboratório e a resistência das células do paciente afetam a eficiência com que o gene CAR se integra em qualquer lote. Portanto, os desenvolvedores devem monitorar o número de cópias do transgene CAR das células para evitar dosar um paciente com células que tenham muitas ou poucas cópias.
Se as células CAR-T tiverem muitas cópias do transgene CAR, o paciente corre um risco maior de sofrer toxicidades graves e potencialmente fatais.5
Por outro lado, se um lote de células não obtivesse nenhuma cópia, seria ineficaz. O FDA dos EUA indicou que as células CAR-T devem carregar entre uma e quatro cópias do transgene, atingindo um equilíbrio.6
O número de cópias do transgene é monitorado usando vários métodos, mas os desenvolvedores historicamente preferiram a qPCR para essa finalidade. Infelizmente, como essa técnica não é exata ou precisa o suficiente para rastrear pequenas concentrações de DNA transgênico, essa prática coloca a saúde do paciente em maior risco.
Usando a tecnologia ideal para obter a contagem certa
A qPCR pode apenas estimar o número de cópias do transgene. A técnica depende de um profissional para realizar manualmente diluições em série de uma amostra que gerará uma curva padrão – um processo que é menos sensível porque é suscetível a erro humano e variabilidade de operador para operador.
Por causa dessa limitação, a qPCR é incapaz de mensurar até uma cópia do gene por célula e não pode quantificar diretamente se as células CAR-T contêm um número seguro de cópias do transgene CAR.
Por outro lado, a sensibilidade necessária é obtida através da Droplet Digital PCR (ddPCR), um método projetado para a quantificação absoluta de ácidos nucleicos. A precisão e a sensibilidade da ddPCR a torna passível de quantificar o número de cópias do transgene em quantidades mínimas, como uma única cópia, e é adequada para enfrentar outros desafios ao longo do desenvolvimento e fabricação de células CAR-T, como persistência de CAR-T e contaminação em lote.7
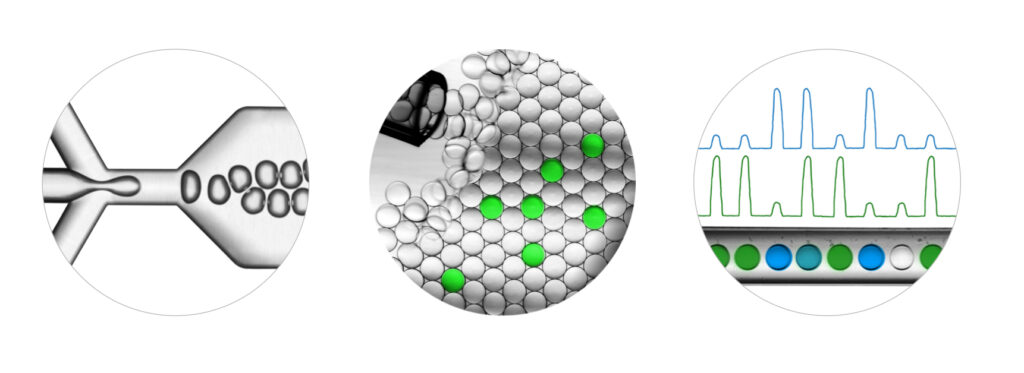
Efetivamente, esse processo pode ser pensado como milhares de amostras individuais sendo submetidas à amplificação simultaneamente, algumas das quais contêm uma cópia do transgene CAR.
Reações independentes ocorrem em cada gota, mas a amplificação e a produção de um sinal fluorescente ocorrem apenas em gotas contendo o transgene. As gotas são quantificadas em um leitor, que pode ser usado para extrapolar a concentração exata do transgene CAR naquele lote de células.
Detectando número de cópias relevantes de CAR
A sensibilidade superior da ddPCR foi demonstrada em bancada.8 Pesquisadores da Universidade de Ciência e Tecnologia de Huazhong em Wuhan, China, compararam os principais parâmetros de desempenho da ddPCR e da qPCR.
Eles avaliaram cada método quanto sua capacidade de quantificar padrões de DNA e amostras de sangue de pacientes submetidos à terapia com células CAR-T. Descobriram, então, que a ddPCR era mais sensível quando usada para medir os padrões de DNA de CAR diluídos, detectando até 3,2 cópias/mL, enquanto a qPCR não conseguia detectar uma concentração tão baixa do transgene.
Da mesma forma, ao medir a persistência de CAR no sangue do paciente, o limite de detecção da qPCR foi de 20 cópias/reação, enquanto na ddPCR foi de 5 cópias/reação, mostrando melhor repetibilidade e reprodutibilidade.
Medindo a persistência
Além da potência, a persistência das células CAR-T – o período em que as células estão vivas no corpo do paciente – deve ser ajustada para otimizar o benefício terapêutico.
Depois que as células CAR-T são infundidas de volta em um paciente, elas circulam por toda a corrente sanguínea, destruindo todas as células cancerígenas que encontram. As células devem estar ativas por alguns meses após o tratamento para terem tempo suficiente de fazerem seu trabalho.
No entanto, é importante que elas não vivam muito. As células CAR-T que persistem mesmo após o câncer ter entrado em remissão podem levar a efeitos colaterais indesejados, como eventos neurológicos adversos.8
Os médicos podem rastrear a persistência das células CAR-T com o tempo usando a ddPCR para medir essas células no sangue, aplicando os dados resultantes para otimizar a segurança e a eficácia do tratamento.9
Detecção de vírus competentes para replicação e outros contaminantes
Os fabricantes também devem garantir que os vetores virais usados para produzir suas células CAR-T não possam se replicar e persistir por tempo indefinido no paciente.
Tal cenário levaria a graves consequências para a saúde. Este evento ainda não foi registrado em humanos, mas, como segurança, o FDA recomenda que os desenvolvedores testem lentivírus competentes para replicação em vários estágios ao longo do processo de fabricação e no sangue do paciente após a administração da terapia.10
Devido à sua alta sensibilidade, a tecnologia de ddPCR é a ferramenta ideal para detectar níveis extremamente baixos de vírus competentes para replicação, de modo que qualquer instância pode ser rastreada antes que as células sejam introduzidas nos pacientes.11 Os ensaios de ddPCR também podem ser usados em cada estágio para triagem de lotes de células CAR-T em relação a outros contaminantes microbianos.
Conclusão
À medida que o campo da imunoterapia evolui, o desenvolvimento da terapia com células CAR-T tende a se tornar mais refinado e exigirá métodos de controle de qualidade correspondentes.
Atualmente, cinco terapias CAR-T foram aprovadas pelo FDA para o tratamento de mieloma múltiplo e linfoma. Contudo, o campo está ganhando força, usando células CAR-T contra tumores sólidos e desenvolvendo novas gerações de designs CAR-T com maior capacidade para abordar uma ampla variedade de cânceres.12–14
Essas novas estratégias de terapia precisarão ser avaliadas para prever sua funcionalidade dentro do corpo. Em sua essência, a ddPCR é um método altamente versátil e sensível para quantificar ácidos nucleicos, que pode aumentar a precisão em todas as etapas do processo de fabricação, tornando-o adequado para garantir a segurança e a eficácia das atuais e futuras terapias com células CAR-T.
Por meio de práticas de fabricação e controle de qualidade rigorosos, os desenvolvedores de CAR-T podem trabalhar com os reguladores para continuar aprimorando os processos que envolvem essa terapia. Por meio de seu trabalho, eles continuarão a trazer para o mercado terapias ainda mais inovadoras e relevantes para a saúde das pessoas.
Referências
- www.ncbi.nlm.nih.gov/pmc/articles/PMC6293462.
- www.ncbi.nlm.nih.gov/pmc/articles/PMC6928196.
- https://clinicaltrials.gov.
- www.fda.gov/news-events/press-announcements/statement-fda-commissioner-scott-gottlieb-md-and-peter-marks-md-phd-director-center-biologics.
- https://pubmed.ncbi.nlm.nih.gov/27207799.
- www.liebertpub.com/doi/full/10.1089/hgtb.2017.078.
- https://translational-medicine.biomedcentral.com/articles/10.1186/s12967-020-02358-0.
- >www.sciencedirect.com/science/article/pii/S1525157820300519.
- www.ncbi.nlm.nih.gov/pmc/articles/PMC7243121.
- http://pdfs.semanticscholar.org/10d0/b090d5e3219fca6a9362e02e95cbe9d90134.pdf.
- https://pubmed.ncbi.nlm.nih.gov/33715950.
- https://hillman.upmc.com/mario-lemieux-center/treatment/car-t-cell-therapy/fda-approved-therapies.
- www.nature.com/articles/s41408-021-00459-7.
- https://jhoonline.biomedcentral.com/articles/10.1186/s13045-020-00910-5.
FONTE: Manufacturing Chemist